Pada kesempatan kali ini saya akan mencoba membahas beberapa materi perkuliahan yang pernah saya peroleh selama kuliah di kampus. Hal ini disebabkan karena setelah mengikuti beberapa tes rekrutmen perusahaan pada tahap technical test dibutuhkan pengetahuan dasar seputar bidang atau posisi pekerjaan yang akan kita lamar. Contohnya saat saya mengikuti tahap technical test untuk KPC dan Saipem, saya kalang kabut karena belum mempersiapkan materi untuk mengerjakan soal-soal tes dimana pada soal-soal tersebut terdapat soal-soal konversi energi khususnya termodinamika teknik. Pada bagian ini saya akan mencoba menjelaskannya dengan kata-kata yang mudah dimengerti agar mudah diingat. Sumbernya saya rangkum dari diktat kuliah.
Langsung saja ke bagian pembahasan dasar termodinamika.
Termodinamika aslinya berasal dari bahasa Yunani, yaitu therme dan dynamics. Therme berarti panas dan dynamics berarti perpindahan. Sehingga bisa diartikan sebagai perpindahan panas atau perpindahan energi pada suatu sistem. Ilmu termodinamika sendiri merupakan ilmu yang mempelajari perpindahan energi dari suatu sistem dan
hubungan antara sifat-sifatnya.
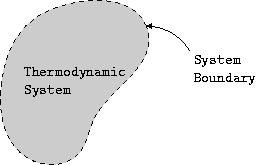
Sistem-Sistem Termodinamika
- Sistem (system): Merupakan subjek yang kita analisis. Dari gambar diatas yang merupakan sistem termodinamika adalah yang berwarna abu-abu di dalam garis putus-putus.
- Sekeliling (surrounding): Merupakan semua yang ada di sekeliling atau di luar sistem. Dari gambar diatas yang merupakan sekeliling adalah yang berada di luar garis putus-putus.
- Batas sistem (boundary): Merupakan batas maya antara sistem dan sekeliling. Dari gambar diatas yang merupakan batas sistem adalah garis putus-putus.
Jenis-Jenis Sistem Termodinamika
- Sistem tertutup (massa atur): energi dapat melewati batas sistem, massa tidak dapat melewati batas sistem.
 |
| Contoh massa atur |
- Sistem terbuka (volume atur): energi dan massa dapat melewati batas sistem.
 |
| Contoh volume atur |
- Sistem terisolasi: energi dan massa tidak dapat melewati batas sistem.
Rumus dan Satuan
Beberapa rumus yang umum dipakai dengan satuannya adalah:
- Gaya: F = m.a = [kg.m/s2] = [N] = [newton]
- Kerja: W = F.x = [kg.m2/s2] = [Nm] = [J] = [joule]
- Daya: P = W/t = [kg.m2/s3] = [J/s] = [W] = [watt]
- Tekanan: p = F/A = [kg/ms2] = [N/m2] = [Pa] = [pascal]
Prefiks Satuan
Proses Termodinamika
- Proses adiabatik (isolasi): proses dimana Q=0 atau tidak ada perpindahan energi/panas.
- Proses isokhorik: proses volume konstan. (pada wadah kaku)
- Proses isobarik: proses tekanan konstan. (pada pemanas, pendingin, ruang bakar, ketel)
- Proses isotermal: proses temperatur konstan. (pada proses kompresi yang perlahan)
- Proses isentropik: proses entropi konstan.
- Proses isenthalpik: proses enthalpi konstan.
Hukum Termodinamika
1. Pernyataan Clausius
"Tidak mungkin suatu sistem apapun bekerja sedemikian rupa sehingga hasil satu-satunya adalah perpindahan energi sebagai panas dari sistem yang lebih dingin ke sistem yang lebih panas."
2. Pernyataan Kelvin-Planck
"Tidak mungkin suatu sistem beroperasi dalam siklus termodinamika dan memberikan sejumlah netto kerja ke sekeliling sambil menerima energi panas dari satu reservoir termal."
- Kerja: W = F.x = [kg.m2/s2] = [Nm] = [J] = [joule]
- Daya: P = W/t = [kg.m2/s3] = [J/s] = [W] = [watt]
- Tekanan: p = F/A = [kg/ms2] = [N/m2] = [Pa] = [pascal]
Prefiks Satuan
 |
| Prefiks |
Proses Termodinamika
- Proses adiabatik (isolasi): proses dimana Q=0 atau tidak ada perpindahan energi/panas.
- Proses isokhorik: proses volume konstan. (pada wadah kaku)
- Proses isobarik: proses tekanan konstan. (pada pemanas, pendingin, ruang bakar, ketel)
- Proses isotermal: proses temperatur konstan. (pada proses kompresi yang perlahan)
- Proses isentropik: proses entropi konstan.
- Proses isenthalpik: proses enthalpi konstan.
Hukum Termodinamika
- Hukum Termodinamika 0 (nol)
"Jika dua
benda disatukan dalam kesetimbangan termal dengan benda ketiga, maka ketiga
benda tersebut akan berada dalam kesetimbangan termal (temperaturnya sama)".
Hukum termodinanika 0 ini secara tidak langsung menyatakan bahwa alat ukur temperatur merupakan benda ketiga yang dapat digunakan untuk mengukur temperatur dua buah benda dan menyatakan bahwa kedua benda tersebut berada dalam keadaan setimbang (temperaturnya sama).
- Hukum Termodinamika 1
"Pada
proses adiabatik (Q = 0), maka kerja
netto yang terjadi antara dua tingkat keadaan selalu sama. Oleh karena itu, kerja oleh atau dari suatu sistem tertutup yang mengalami
proses adiabatik hanya bergantung pada tingkat keadaan awal dan akhirnya saja
dan tidak bergantung pada proses adiabatiknya".
Sebenarnya hukum ini menyatakan bahwa perubahan energi dalam (E) dari sistem tertutup sama dengan total dari jumlah energi kalor (Q) yang masuk ke dalam sistem dan kerja (W) yang dilakukan kepada sistem.
Konvensi tanda untuk energi kalor dan kerja:
Q > 0 : panas berpindah dari sekeliling ke sistem (kalor masuk ke sistem)
Q < 0 : panas berpindah dari sistem ke sekeliling (kalor keluar dari sistem)
W > 0 : kerja dilakukan oleh sistem, pada sekeliling (kerja keluar dari sistem)
W < 0 : kerja dilakukan pada sistem, oleh sekeliling (kerja masuk ke sistem)
Konvensi tanda untuk energi kalor dan kerja:
Q > 0 : panas berpindah dari sekeliling ke sistem (kalor masuk ke sistem)
Q < 0 : panas berpindah dari sistem ke sekeliling (kalor keluar dari sistem)
W > 0 : kerja dilakukan oleh sistem, pada sekeliling (kerja keluar dari sistem)
W < 0 : kerja dilakukan pada sistem, oleh sekeliling (kerja masuk ke sistem)
- Hukum Termodinamika 2
Tidak ada satu pernyataan untuk hukum termodinamika 2. Pada dasarnya hukum termodinamika 2 ini berdasarkan hasil eksperimental.1. Pernyataan Clausius
"Tidak mungkin suatu sistem apapun bekerja sedemikian rupa sehingga hasil satu-satunya adalah perpindahan energi sebagai panas dari sistem yang lebih dingin ke sistem yang lebih panas."
2. Pernyataan Kelvin-Planck
"Tidak mungkin suatu sistem beroperasi dalam siklus termodinamika dan memberikan sejumlah netto kerja ke sekeliling sambil menerima energi panas dari satu reservoir termal."
- Hukum Termodinamika 3
"Entropi dari zat kristal murni pada temperatur absolut nol (0 K atau 0o R) adalah nol".
Hukum ini menyatakan bahwa pada saat suatu sistem mencapai temperatur
nol absolut, semua proses akan berhenti dan entropi sistem akan
mendekati nilai minimum. Hukum ini juga menyatakan bahwa entropi benda
berstruktur kristal sempurna pada temperatur nol absolut bernilai nol.
Rangkuman Persamaan Termodinamika
-Massa Atur
-Volume Atur
FIN








Tidak ada komentar:
Posting Komentar